A ligação covalente é um tipo de ligação química caracterizada pelo compartilhamento de um ou mais pares de elétrons entre átomos, causando uma atração mútua entre eles, que mantêm amolécula resultante unida. O nome ligação covalente surgiu em 1939.
Praticamente todos os ametais da tabela periódica estabelecem entre si ligações onde há compartilhamento de elétrons, ou seja, o par ou pares eletrônicos compartilhados fazem parte, quase que simultaneamente, das eletrosferas dos participantes da ligação.
Alguns compostos como CO2, HCl, SiO2, AlCl3, são exemplos de espécies de maior caráter covalente (frente ao caráter iônico – até porque esse não está totalmente excluído): assim, tomando o dióxido de carbono, os dois átomos de oxigênio (com 6 elétrons de valência) adquirem mais 2 elétrons do carbono (com 4 de valência) e completam o octeto. Da mesma forma, como o carbono compartilha 4 pares com cada átomo de oxigênio (portanto, 8 elétrons) também adquire condição de octeto completo.
Mundo da Química
Blog, exclusivamente para conseguir solucionar as duvidas dos estudantes de química, melhorando assim o seu entendimento de todos os assuntos referentes a essa matéria que de certa forma é complicada para o entendimento de alguns estudantes.
terça-feira, 11 de dezembro de 2012
segunda-feira, 10 de dezembro de 2012
Ligação Covalente
A. ligação covalente é um tipo de ligação química caracterizada pelo compartilhamento de um ou mais pares de elétrons entre átomos, causando uma atração mútua entre eles, que mantêm a molécula resultante unida. O nome ligação covalente surgiu em 1939
Ligações covalentes normalmente ocorrem entre átomos com eletronegatividades similares e altas (geralmente entre dois não-metais), dos quais remover completamente um elétron requer muita energia.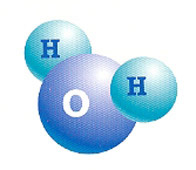

Átomos tendem a compartilhar elétrons de modo que suas camadas eletrônicas externas sejam preenchidas e eles adquiram uma distribuição eletrônica mais estável. A força dessas ligações é maior que a das interações intermoleculares e comparável à da ligação iônica. Existem dois tipos principais, a ligação-σ (ligação sigma) e a ligação-π (ligação pi).
- Ligação sigma: é uma ligação entre dois orbitais atômicos. Pode ser dada como a ligação entre dois orbitais s, ou entre um orbital s e um p, ou ainda entre dois orbitais p, onde em todos esses casos os orbitais se interpenetram frontalmente. Normalmente o que ocorre é o seguinte: os de dois átomos de carbono, por exemplo, que são orbitais p, se ligam. A primeira ligação a ser formada é um sigma, porque os dos orbitais que estiverem mais próximos um do outro se interpenetram frontalmente.
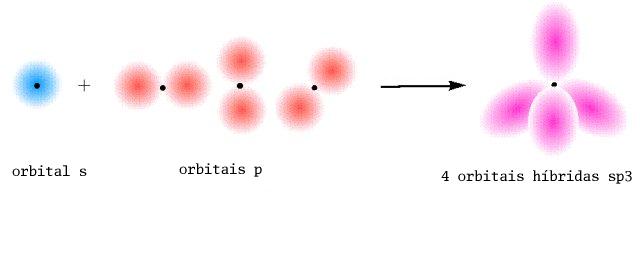
- Ligações pi (ou ligações π) são ligações químicas covalentes, nas quais dois lóbulos de um orbital eletrônico interseccionam dois lóbulos de outros orbitais eletrônicos. Apenas um dos planos nodais daquele orbital passa pelos núcleos envolvidos na ligação. É a ligação característica de compostos com duplas ou triplas ligações como o propeno e o etino.Deve-se notar que em uma ligação dupla apenas uma ligação é pi, a outra é sigma (σ). Ligações sigma são mais estáveis.Outra observação a se fazer é que ao determinar a geometria de uma molécula, as ligações duplas e triplas contam como apenas uma nuvem eletrônica.
Ligação Iônica
Ligação iônica é um tipo de ligação química baseada na atração eletrostática entre dois íons carregados com cargas opostas.
Na formação da ligação iônica, um metal doa um elétron, devido a sua baixa eletronegatividade formando um íon positivo ou cátion. No sal de cozinha, as ligações entre os íons sódio e cloreto são iônicas.
 |
| Ligação iônica que dá origem ao sal de cozinha |
Geralmente ligações iônicas se formam entre um metal e um ametal. O átomo do ametal tem uma configuração eletrônica semelhante a de um gás nobre, quase totalmente preenchida de elétrons. Eles têm alta eletronegatividade, e facilmente ganham elétrons formando um íon negativo ou ânion. Os dois ou mais íons logo se atraem devido a forças eletrostáticas. Ligações desse tipo são mais fortes que ligações de hidrogênio, e têm força menor que as ligações covalentes.
Os compostos iônicos, em geral, apresentam altos pontos de fusão e ebulição, são sólidos, duros e quebradiços e solubilizam-se facilmente em solventes polares.
Estrutura Iônica
Compostos iônicos no estado sólido formam uma estrutura iônica contínua em um cristal iônico. A forma mais simples de cristal iônico é um cúbico simples. Nessa forma todos os átomos estão posicionados nas extremidades de um cubo. Essa célula unitária tem a massa que é a mesma de 1 dos átomos envolvidos. Quando todos os íons tem aproximadamente o mesmo tamanho, eles podem formar uma estrutura iguais chamada cúbica de face-centrada, mas, quando os íons tem tamanhos diferentes, a estrutura é geralmente cúbica de corpo-centrado (2 vezes a massa). Em retículos iônicos o número de coordenação se refere ao número de íons que cada retículo está ligado.

Ligações Químicas Interatômicas
Ligações Interatômicas - União que ocorre entre átomos para formar novas substâncias químicas.
Existem três tipos de ligações interatômicas:
Substâncias iônicas: Essa ligação ocorre quando dois átomos com diferença elevada de eletronegatividade estabelecem uma relação entre eles, em que o que possui maior eletronegatividade traz para si o elétron do átomo menos eletronegativo. Assim, a ligação iônica se caracteriza pela doação de elétrons, diferentemente da interação molecular, em que há apenas um compartilhamento de elétrons. Geralmente, as ligações iônicas são feitas entre átomos dos metais com os não-metais, pois possuem grande diferença de eletronegatividade (os não-metais tendem a "roubar" os elétrons dos metais).
Substâncias moleculares: é uma substância formada basicamente por moléculas.As substâncias moleculares geralmente possuem ponto de fusão e ebulição menores que as compostos iônicos, as interações entre as moléculas são muito pequenas.Essas substâncias não conduzem corrente elétrica no estado solido nem do liquido.
Substâncias metálicas: São substâncias caracterizadas por sua boa condutividade eléctrica e de calor, geralmente apresentando cor prateada ou amarelada,um alto ponto de fusão e de ebulição e uma elevada dureza.Conduzem corrente elétrica tanto no estado sólido quanto no liquido.
Existem três tipos de ligações interatômicas:
- Substâncias iônicas
- Substâncias metálicas
- Substâncias moleculares
Substâncias iônicas: Essa ligação ocorre quando dois átomos com diferença elevada de eletronegatividade estabelecem uma relação entre eles, em que o que possui maior eletronegatividade traz para si o elétron do átomo menos eletronegativo. Assim, a ligação iônica se caracteriza pela doação de elétrons, diferentemente da interação molecular, em que há apenas um compartilhamento de elétrons. Geralmente, as ligações iônicas são feitas entre átomos dos metais com os não-metais, pois possuem grande diferença de eletronegatividade (os não-metais tendem a "roubar" os elétrons dos metais).
Substâncias moleculares: é uma substância formada basicamente por moléculas.As substâncias moleculares geralmente possuem ponto de fusão e ebulição menores que as compostos iônicos, as interações entre as moléculas são muito pequenas.Essas substâncias não conduzem corrente elétrica no estado solido nem do liquido.
Substâncias metálicas: São substâncias caracterizadas por sua boa condutividade eléctrica e de calor, geralmente apresentando cor prateada ou amarelada,um alto ponto de fusão e de ebulição e uma elevada dureza.Conduzem corrente elétrica tanto no estado sólido quanto no liquido.
Distribuição Eletrônica

Os elétrons estão distribuídos em camadas ao redor do núcleo. Admite-se a existência de 7 camadas eletrônicas, designados pelas letras maiúsculas:
K,L,M,N,O,P e Q. À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.
K,L,M,N,O,P e Q. À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.
As camadas da eletrosfera representam os níveis de energia da eletrosfera. Assim, as camadas K,L,M,N,O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.
Por meio de métodos experimentais, os químicos concluíram que o número máximo de elétrons que cabe em cada camada ou nível de energia é:
Por meio de métodos experimentais, os químicos concluíram que o número máximo de elétrons que cabe em cada camada ou nível de energia é:
| Nível de energia | Camada | Número máximo de elétrons |
| 1º | K | 2 |
| 2º | L | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | O | 32 |
| 6º | P | 18 |
| 7º | Q | 2 (alguns autores admitem até 8) |
Em cada camada ou nível de energia, os elétrons se distribuem em subcamadas ou subníveis de energia, representados pelas letras s,p,d,f, em ordem crescente de energia.
O número máximo de elétrons que cabe em cada subcamada, ou subnivel de energia, também foi determinado experimentalmente:
O número máximo de elétrons que cabe em cada subcamada, ou subnivel de energia, também foi determinado experimentalmente:
energia crescente
---------------------------------->
---------------------------------->
| Subnível | s | p | d | f |
| Número máximo de elétrons | 2 | 6 | 10 | 14 |
O número de subníveis que constituem cada nível de energia depende do número máximo de elétrons que cabe em cada nível. Assim, como no 1ºnível cabem no máximo 2 elétrons, esse nível apresenta apenas um subnível s, no qual cabem os 2 elétrons. O subnível s do 1º nível de energia é representado por 1s.
Como no 2º nível cabem no máximo 8 elétrons, o 2º nível é constituído de um subnível s, no qual cabem no máximo 2 elétrons, e um subnível p, no qual cabem no máximo 6 elétrons. Desse modo, o 2º nível é formado de dois subníveis, representados por 2s e 2p, e assim por diante.
Como no 2º nível cabem no máximo 8 elétrons, o 2º nível é constituído de um subnível s, no qual cabem no máximo 2 elétrons, e um subnível p, no qual cabem no máximo 6 elétrons. Desse modo, o 2º nível é formado de dois subníveis, representados por 2s e 2p, e assim por diante.
Resumindo:
| Nível | Camada | Nº máximo de elétrons | Subníveis conhecidos |
| 1º | K | 2 | 1s |
| 2º | L | 8 | 2s e 2p |
| 3º | M | 18 | 3s, 3p e 3d |
| 4º | N | 32 | 4s, 4p, 4d e 4f |
| 5º | O | 32 | 5s, 5p, 5d e 5f |
| 6º | P | 18 | 6s, 6p e 6d |
| 7º | Q | 2 (alguns autores admitem até 8) | 7s 7p |
Linus Carl Pauling (1901-1994), químico americano, elaborou um dispositivo prático que permite colocar todos os subníveis de energia conhecidos em ordem crescente de energia. É o processo das diagonais, denominado diagrama de Pauling, representado a seguir. A ordem crescente de energia dos subníveis é a ordem na sequência das diagonais.
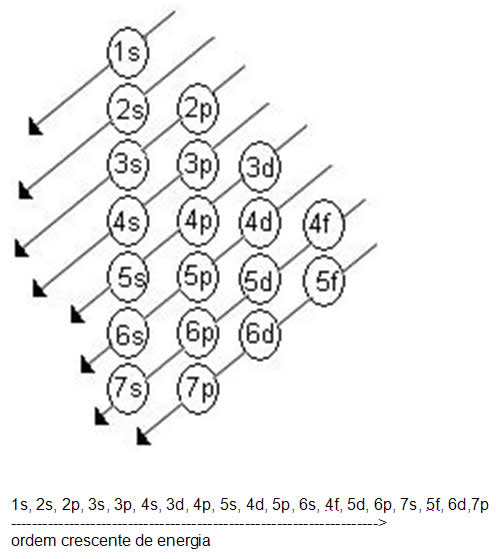
Acompanhe os exemplos de distribuição eletrônica:
1 - Distribuir os elétrons do átomo normal de manganês (Z=25) em ordem de camada.
Solução:
Se Z=25 isto significa que no átomo normal de manganês há 25 elétrons. Aplicando o diagrama de Pauling, teremos:
K - 1s2
L - 2s2 2p6
M - 3s2 3p6 3d5
N - 4s2 4p 4d 4f
O - 5s 5p 5d 5f
P - 6s 6p 6d
Q - 7s 7p
Resposta: K=2; L=8; M=13; N=2
2 - Distribuir os elétrons do átomo normal de xenônio (Z=54) em ordem de camada.
Solução:
K - 1s2
L - 2s2 2p6
M- 3s2 3p6 3d10
N- 4s2 4p6 4d10 4f
O- 5s2 5p6 5d 5f
P- 6s 6p 6d
Q- 7s 7p
Resposta: K=2; L=8; M=18; N=18; O=8
Há alguns elementos químicos cuja distribuição eletrônica não “bate” com o diagrama de Pauling.
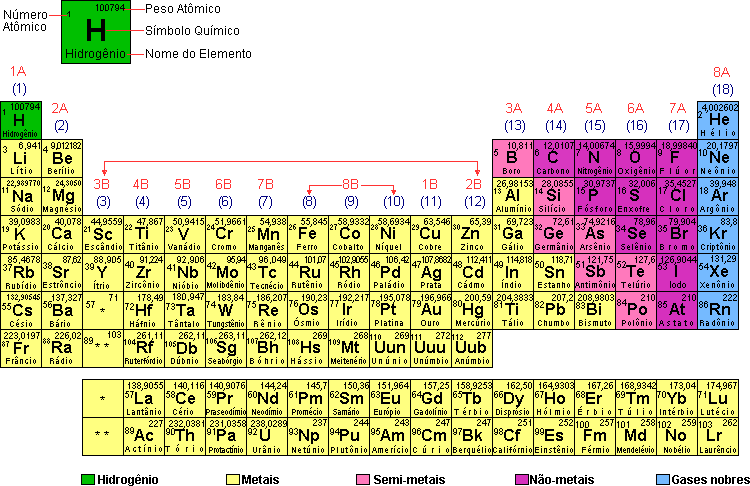
Tabela Periodica
A tabela periódica dos elementos químicos é a disposição sistemática dos elementos, na forma de uma tabela, em função de suas propriedades. São muito úteis para se preverem as características e tendências dos átomos. Permite, por exemplo, prever o comportamento de átomos e das moléculas deles formadas, ou entender porque certos átomos são extremamente reativos enquanto outros são praticamente inertes. Permite prever propriedades como eletronegatividade, raio iônico, energia de ionização.
A tabela periódica consiste num ordenamento dos elementos conhecidos de acordo com as suas propriedades físicas e químicas, em que os elementos que apresentam as propriedades semelhantes são dispostos em colunas. Este ordenamento foi proposto pelo químico russo Dmitri Mendeleiev , substituindo o ordenamento pela massa atômica. Ele publicou a tabela periódica em seu livro Princípios da Química em 1869, época em que eram conhecidos apenas cerca de 60 elementos químicos.
Assinar:
Postagens (Atom)